CLINUVEL Kommuniqué II
| Melbourne, Australia, 31 March 2022 |
ASX: XETRA-DAX: Level 1 ADR: |
CUV UR9 CLVLY |
Liebe Aktionäre, Freunde
Einleitung
(Herr Malcolm Bull, Head of Australian Operations & Investor Relations)
Die Welt ist zunehmend unsicher geworden, da der Krieg in Europa den anhaltenden Überhang von COVID-19 verschärft hat, Inflationsdruck aufgebaut hat, die Besorgnis über höhere Zinsen und ein langsameres Wirtschaftswachstum geweckt wurde. Im März hoben sowohl die US-Notenbank als auch die Bank of England ihren offiziellen Leitzinssatz um 0,25 % an, und weitere Erhöhungen werden erwartet. Die Prognosen für das Weltwirtschaftswachstum für 2022 werden voraussichtlich auch nach unten korrigiert, da die Inflation ansteigt, insbesondere aufgrund deutlich höherer Energie- und Rohstoffpreise und der Umlenkung von Ressourcen für einen ungerechtfertigten Krieg.
Bei CLINUVEL ist unser Weg vorgezeichnet und wir bauen den kommerziellen Betrieb weiter aus und bringen das erweiterte klinische Programm trotz des schwierigen Umfelds voran, um ein diversifiziertes und nachhaltiges Pharmaunternehmen aufzubauen.
In diesem Kommuniqué decken wir mehrere Bereiche der Aktivitäten des Unternehmens ab, insbesondere:
- die Gründe für den Aufbau einer Melanocortin-Spezialpharmagruppe;
- Fortschritte bei wichtigen klinischen Programmen;
- unser Qualitätssicherungsansatz und -rahmen;
- Überprüfung der wichtigsten Errungenschaften in Handelsangelegenheiten;
- jüngste Entwicklungen in den Bereichen Kommunikation und Investor Relations;
- Einblicke in den Geschäftsansatz und die Zukunft von CLINUVEL von Dr. Wolgen.
Bei CLINUVEL ist unser Weg vorgezeichnet und wir bauen den kommerziellen Betrieb weiter aus und bringen das erweiterte klinische Programm trotz des schwierigen Umfelds voran, um ein diversifiziertes und nachhaltiges Pharmaunternehmen aufzubauen.
…, haben wir einzigartige Fachkenntnisse in bestimmten Bereichen aufgebaut, die es uns ermöglichen, wissenschaftliche Erkenntnisse in pharmazeutische und Gesundheitsprodukte. umzusetzen.
Aufbau einer Melanocortin Specialty Pharmaceutical Group
(Herr Lachlan Hay, Director of Global Operations)
Die Mission von CLINUVEL als Organisation unterstreicht unseren Wunsch, wissenschaftliche Konzepte und Durchbrüche in kommerzielle Produkte umzusetzen, wobei der Schwerpunkt auf Produkten liegt, die Patienten und einem breiteren Publikum helfen, denen es an Alternativen mangelt. Kurz gesagt, wir identifizieren diejenigen mit einem hohen Bedarf und entwickeln neuartige, wissenschaftlich fundierte Lösungen. Obwohl dieser Ansatz auf viele Unternehmungen angewendet werden könnte, haben wir einzigartige Fachkenntnisse in bestimmten Bereichen aufgebaut, die es uns ermöglichen, wissenschaftliche Erkenntnisse in pharmazeutische und Gesundheitsprodukte umzusetzen.
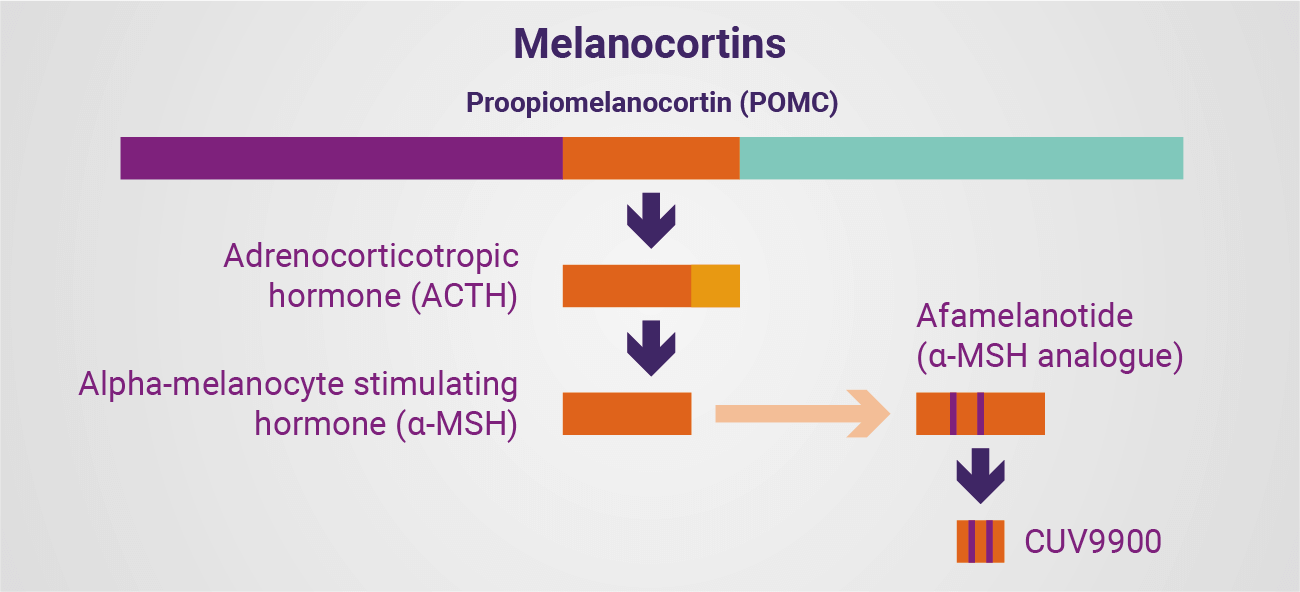
Im Mittelpunkt dieses über Jahrzehnte angesammelten Wissens steht eine weltweit führende Expertise zur Rolle der Melanocortine, ihrer Analoga und spezifischer, auf die menschliche Physiologie abgestimmter Formulierungen (fertige Darreichungsformen). Die vielleicht am häufigsten berichteten Funktionen des Melanocortin-1-Rezeptors (MC1R) sind diejenigen, die für das menschliche Auge am sichtbarsten sind: Melanogenese. Natürlich vorkommendes Alpha-Melanozyten-stimulierendes Hormon – und seine Analoga, einschließlich Afamelanotid – binden an den Melanocortin-1-Rezeptor auf den pigmentproduzierenden Zellen in der Haut, den Melanozyten und Keratinozyten, um die Produktion und den Transport von Melanin zu stimulieren. Zusätzlich zu der offensichtlichen dermalen Verdunkelungswirkung von Melanin spielt das Pigment eine lichtschützende Rolle, indem es die Haut vor Schäden durch Licht, ultraviolettes (UV) und hochenergetisches sichtbares Licht (HEV) schützt.
Wir diskutieren jetzt nicht die wichtigen Wirkungen von Afamelanotid auf MC4R und seine Potenz als Hormon, sondern überlassen dies dem wissenschaftlichen Team für einen anderen Tag.
Nach zwei Jahrzehnten des Experimentierens wurde immer deutlicher, dass ein natürlicher Weg zur Aktivierung menschlicher Zellen bevorzugt wird und langfristig der einzig sichere Weg ist.
Zusätzlich zu Melanocortinen können eine Reihe synthetischer Medikamente die Melanogenese aktivieren, wenn auch nicht über den natürlichen Weg. Nach zwei Jahrzehnten des Experimentierens wurde immer deutlicher, dass ein natürlicher Weg zur Aktivierung menschlicher Zellen bevorzugt wird und langfristig der einzig sichere Weg ist. Abweichungen von diesen physiologischen Wegen geben Anlass zu Bedenken hinsichtlich kurz- und langfristiger Nebenwirkungen. Beispielsweise ist bekannt, dass cAMP-Agonisten die meisten Zellen in unserem Körper beeinflussen und den Bluthochdruck erhöhen, während ein neues synthetisches kleines Molekül Berichten zufolge Verfärbungen der Handflächen, Fußsohlen und alarmierend der Augen verursacht. Diese Wirkungen zeigen deutlich, dass der Syntheseweg nicht der natürliche und biologische Weg der Melanogenese ist, dem gefolgt wird, um den Körper zu unterstützen.
Daher besteht eine Schlüsselstärke bei der Entwicklung menschlicher Melanocortine und ihrer bekannten Analoga darin, dass die aktivierten Signalwege von den körpereigenen Zellen erkannt werden, allgemein gut bekannt sind und über ein beträchtliches wissenschaftliches Verständnis verfügen, um ihre erweiterte Verwendung zu rechtfertigen. Bei einer hormonellen Stimulation zu bleiben, ist der einzig sichere Weg.
In ihrer einfachsten Form sind die Melanocortine eine Familie von Hormonen, bioaktiven Peptiden und ihren Analoga, die von Proopiomelanocortin (POMC), einem 241 Aminosäuren umfassenden Polypeptid, das in der Hypophyse produziert wird, abgeleitet sind. Diese Derivate sind in der Lage, an fünf spezifische Melanocortin-Rezeptoren (MC1R-MC5R) auf Zellen im ganzen Körper zu binden, um dann ihre Wirkung zu entfalten. Natürliches adrenocorticotropes Hormon (ACTH) ist ein langes Derivat von POMC, bestehend aus 39 Aminosäuren, das als synthetische Verbindung – in einigen Fällen – weiter auf 24 Aminosäuren verkürzt wird. Das Hormon bindet an den MC2R, um dann seine Wirkung zu entfalten.
Daher besteht eine Schlüsselstärke bei der Entwicklung enschlicher Melanocortine und ihrer bekannten Analoga darin,
dass die aktivierten Signalwege von den körpereigenen Zellen erkannt werden, allgemein gut bekannt sind und über ein beträchtliches wissenschaftliches Verständnis verfügen, um ihre erweiterte Verwendung zu rechtfertigen.
Alpha-Melanozyten-stimulierendes Hormon (α-MSH) umfasst die ersten 13 Aminosäuren der ACTH-Sequenz und bindet mit unterschiedlicher Affinität an MC1R, MC3R, MC4R und MC5R, um seine Wirkung auszuüben. Obwohl α-MSH am besten für die Melanogenese (die defensive Bräunungswirkung) bekannt ist, wird davon ausgegangen, dass es auch eine breitere Rolle spielt, da sein Hauptrezeptor – MC1R – auf Zellen im ganzen Körper vorhanden ist und auf das Potenzial für künstliche Analoga des natürlichen Hormons hinweist als Therapeutikum verabreicht werden. Tatsächlich liegt der wahre Wert von α-MSH in seiner Wirkung auf eine große Anzahl menschlicher Zellen, die Gefäß-, Nerven- und innere Organsysteme sowie die durch UV/HEV beeinträchtigte DNA beeinflussen. Dieses starke Hormon ist in der Lage, die Flüssigkeitsbildung zu reduzieren und eine Vielzahl von Reaktionen zu stimulieren, wenn es gut und in Maßen verwendet wird. Dieses Potenzial zu verstehen und zu erforschen, ermöglicht die Entwicklung von Therapien.
Genau diesen Ansatz verfolgt CLINUVEL mit Afamelanotid und anderen Molekülen. Durch die Analyse des frühen vorklinischen Wissens über sowohl das natürliche (biologische) α-MSH als auch seine Analoga und die Kombination mit der Expertise des Unternehmens bei der gezielten Behandlung von Zellen über spezifische Dosen und Formulierungen gelangen wir zu dem Potenzial, eine Reihe von zu behandeln Hinweise.
Auf diese Weise können wir die Verwendung eines Medikaments auf Peptidbasis, das derzeit erfolgreich Patienten mit einer äußerst seltenen Erkrankung (erythropoetische Protoporphyrie, EPP) behandelt, für die Verwendung bei der DNA-Reparatur (Xeroderma pigmentosum, XP), der Repigmentierung (Vitiligo) und dem Zentralnervensystem übersetzen; Systemstörungen (arterieller ischämischer Schlaganfall, AIS). Diese Programme werden nun vom Unternehmen aggressiv verfolgt, um festzustellen, welche Patientengruppen am meisten von der Behandlung profitieren können.
Tatsächlich liegt der wahre Wert von α-MSH in seiner Wirkung auf eine große Anzahl menschlicher Zellen, die Gefäß-, Nerven- und innere Organsysteme sowie die durch UV/HEV beeinträchtigte DNA beeinflussen. Dieses starke Hormon ist in der Lage, die Flüssigkeitsbildung zu reduzieren und eine Vielzahl von Reaktionen zu stimulieren, wenn es gut und in Maßen verwendet wird.
Abgesehen von Afamelanotid, aber innerhalb derselben Familie von Hormonen, hat die Analyse von CLINUVEL weiter zu unserem kürzlich angekündigten ACTH-Programm geführt, bei dem sich die Gelegenheit ergab, nicht nur eine sich abzeichnende Marktlücke für bestehende Patienten zu schließen, sondern verschiedene therapeutische Arsenale zu ergänzen sich zu nähern. Hier planen wir, nicht nur ACTH-Formulierungen (NEURACTHEL® Instant und NEURACTHEL® Modified-release) zu kommerzialisieren, sondern auch die therapeutische Anwendung dieses Hormons in identifizierten Patientengruppen mit einem hohen ungedeckten klinischen Bedarf auszuweiten.
Einfach ausgedrückt, die besondere Expertise und das Know-how von CLINUVEL – in Bezug auf Melanocortine, Formulierungen, Dosierung, zelluläre Signalübertragung und klinische Durchführung – ermöglicht es uns, wissenschaftliche Erkenntnisse zu übersetzen und zu erweitern, um mehr Patienten und Einzelpersonen in einem breiteren Publikum zu helfen.
Anfang dieses Monats haben wir eine Aktualisierung des ACTH-Programms angekündigt, wobei die cGMP-Herstellung und die Entwicklungs- und Validierungsarbeiten im Gange sind. Parallel dazu treibt unser Team in Singapur eine Reihe von Projekten auf Melanocortin-Basis voran, um unsere zukünftige Pipeline sowohl als pharmazeutische als auch als Gesundheitslösungen aufzubauen. Die folgende Tabelle gibt einen Status der verschiedenen Formulierungen wieder:
Einfach ausgedrückt, die besondere Expertise und das Know-how von CLINUVEL – in Bezug auf Melanocortine, Formulierungen, Dosierung, zelluläre Signalübertragung und klinische Durchführung – ermöglicht es uns, wissenschaftliche Erkenntnisse zu übersetzen und zu erweitern, um mehr Patienten und Einzelpersonen in einem breiteren Publikum zu helfen.
CLINUVEL’s Melanocortin Portfolio
| Produkt | Dosierung | Formulierung | Status der Produkt |
|---|---|---|---|
| SCENESSE® (Afamelanotid 16 mg) Implant |
Erwachsene | Solid | Kommerziell |
| SCENESSE® ENFANCE (Afamelanotid) |
Kinder 12–17 | Flüssigkeit | In Entwicklung |
| PRENUMBRA® Sofort (Afamelanotid) |
Alle Altersgruppen | Flüssigkeit | cGMP-Produktion |
| PRENUMBRA® Modifiziert (Afamelanotid) |
Erwachsene | Flüssigkeit | In Entwicklung |
| CUV9900 | Erwachsene | Topisch, einwirken lassen | In Entwicklung |
| NEURACTHEL® (ACTH) Sofortig | Erwachsene | Flüssigkeit | cGMP-Entwicklung und -Validierung im Gange |
Das aktive klinische Entwicklungsprogramm von CLINUVEL
| Afamelanotid | |||
|---|---|---|---|
| Indikation & adressierbarer Markt | Therapieansatz von Melanocortin | CLINUVEL Fortschritt | |
| Erythropoetische Protoporphyrie – Erwachsene Prävalenz: 1:140.000 in Europa, USA |
Prävention von Phototoxizität (anaphylaktische Reaktionen und Verbrennungen): Photoprotektion, antioxidatives | SCENESSE® in den USA zugelassen, Europa, Australien, Studien nach der Zulassung laufen | |
| Erythropoetische Protoporphyrie – Pädiatrie | Pädiatrie Prävention von Phototoxizität (anaphylaktische Reaktionen und Verbrennungen): Photoprotektion, Antioxidans | SCENESSE® ENFANCE in der Entwicklung. | |
| Bunte Porphyrie (VP) Prävalenz: 0,3-2:100.000 |
Prävention von Phototoxizität (Blasenbildung): Lichtschutz, antioxidatives | Phase-II-Studie in Planung | |
| Xeroderma Pigmentosum (XP) Prävalenz: 1:1.000.000 |
DNA-Reparatur, Lichtschutz, antioxidatives | Phase-II-Studien laufen bei XP-C, XP-V und krankheitsfreie Probanden. Erste Ergebnisse 2022 fällig. | |
| Vitiligo Europäische Sommerzeit. 45 Millionen Patienten weltweit, zuerst für die Hauttypen IV-VI in Nordamerika |
Repigmentierung, Aktivierung von Melanozytenstammzellen | Phase-II-Kombinationstherapiepiloten abgeschlossen, Afamelanotid gut verträglich (n=55). Phase-II-Monotherapie-Pilotprojekt soll 2022 in den USA beginnen. | |
| Schlaganfall (AIS) 15 Millionen Schlaganfälle pro Jahr, 85 % der Patienten sind nicht geeignet zur Strombehandlung |
Vaso-Aktivierung, antioxidativ, Anti-Onkolytika | Vorläufige Phase-II-Ergebnisse zeigen eine gute Verträglichkeit von Afamelanotid (n=6). Vollständige Ergebnisse fällig 2022. | |
Klinische Programme
(Dr Pilar Bilbao, Leiterin des klinischen Betriebs)
Nachfolgend finden Sie einen Überblick über die wichtigsten Entwicklungen im erweiterten klinischen Programm von CLINUVEL:
Arterieller ischämischer Schlaganfall (AIS)
Anfang diesen Monats haben wir vorläufige Ergebnisse unserer CUV801-Studie veröffentlicht; der ersten Studie von CLINUVEL, die die Anwendung von Afamelanotid bei Patienten mit AIS bewertet. Wir sind von diesen ersten Top-Line-Daten sehr ermutigt und arbeiten mit großer Vorfreude nun fleißig daran, die endgültigen Ergebnisse der Studie zu erfassen, zu überprüfen und zu analysieren. Nicht weniger wichtig ist, dass die erstmalige Anwendung eines Melanocortins bei kritisch kranken Patienten sich bewährt hat, was für die medizinische und wissenschaftliche Gemeinschaft von großem Interesse ist.
Der primäre Endpunkt der CUV801-Studie ist die Sicherheit, wie es in dieser Phase des Programms sein sollte. Im Gegensatz zu anderen Programmen gibt es jedoch einen weiteren Grund für den Fokus auf Sicherheit, da bestehende Schlaganfalltherapien das Ausmaß der Verletzungen von Schlaganfallpatienten verschlimmern können. Die unvorstellbare Tragödie der Verschlechterung des Zustands dieser Patienten muss sorgfältig bewertet werden, wenn ein neues Medikament in dieser Gruppe verwendet wird; Wir haben den ersten Sicherheitstest bestanden.
Kurz zusammengefasst: Wenn ein Patient einen ischämischen Schlaganfall erleidet, wird einem Teil seines Gehirns durch ein Gerinnsel in einer Arterie Sauerstoff und Nährstoffe entzogen, wodurch ein Gewebekern um die Verletzung herum abgetötet wird und eine größere Region des Gehirns einem Schadensrisiko ausgesetzt wird . Bekannt als Penumbra – lateinisch für „Schatten“, da die Region so auf Bildgebungsscans erscheint – kann Gewebe in dieser betroffenen Region wiederhergestellt werden, wenn ein Schlaganfall behandelt werden kann, oder weiter geschädigt werden, wenn der Blutfluss nicht wiederhergestellt wird. Hirnschäden als Folge eines Schlaganfalls sind in der Regel irreversibel, was zu einer dauerhaften und einer lebenslangen Behinderung der Patienten führt. Der Zeitraum nach dem unmittelbaren Schlaganfall ist daher entscheidend für die klinischen Gesamtergebnisse von Schlaganfallpatienten, da eine Behandlung darauf abzielt, die Gesamtauswirkungen des Schlaganfalls zu minimieren.
Die derzeitigen „Goldstandard“-Behandlungen für ischämischen Schlaganfall konzentrieren sich auf die chemische Auflösung und/oder physikalische Entfernung eines Gerinnsels, bekannt als Thrombolyse bzw. Thrombektomie. Die intravenöse thrombolytische Therapie (IVT) beruht auf der Verabreichung von rekombinantem Gewebeplasminogenaktivator (Alteplase oder Tenecteplase; rt-PA), um ein Blutgerinnsel innerhalb eines Blutgefäßes aufzulösen. IVT ist zwar oft sehr effektiv bei der Auflösung von Gerinnseln und der anschließenden Wiederherstellung des Blutflusses, kann aber das Risiko einer tödlichen Hirnblutung bei einem Patienten stark erhöhen, wenn es in einer zu hohen Dosis oder zu lange nach Beginn des Schlaganfalls verabreicht wird. In der allgemeinen Praxis wird anerkannt, dass IVT innerhalb von 4,5 Stunden nach Beginn des Schlaganfalls verabreicht werden muss, wenn es dem Patienten den größten Nutzen bringen soll (dies führt zu sehr niedrigen Aufnahmeraten von IVT, etwa 12 % der Krankenhauseinweisungen im Vereinigten Königreich, zum Beispiel). Thrombektomie stellt auch ein Risiko für Patienten dar. Dieser Prozess der mechanischen Gerinnselentfernung kann innerhalb eines längeren therapeutischen Fensters durchgeführt werden, aber das Gesamtrisiko steigt mit der Zeit. Der Entfernungsprozess ist heikel, erfordert spezielles Training und birgt das Risiko, Gefäße im Gehirn zu reißen, wenn das Gerinnsel nicht leicht entfernt werden kann. Es kann auch nur für Gerinnsel verwendet werden, die in leichter zugänglichen, größeren Blutgefäßen auftreten, wodurch die insgesamt geeignete Patientenpopulation eingeschränkt wird. Obwohl diese Behandlungen sehr effektiv sein können, bergen sie beträchtliche Risiken und sind in ihrer Anwendung begrenzt.
Wir sind von diesen ersten Top-Line-Daten sehr ermutigt und arbeiten mit großer Vorfreude nun fleißig daran, die endgültigen Ergebnisse der Studie zu erfassen, zu überprüfen und zu analysieren.
In der CUV801-Studie wurden den Patienten über einen Zeitraum von acht Tagen bis zu vier Dosen Afamelanotid verabreicht. Dieses umfangreiche therapeutische Fenster wurde gewählt, um die Auswirkungen der Behandlungsintervention in verschiedenen Stadien der Verletzungen der Patienten zu bewerten und zu verstehen, ob Afamelanotid gut vertragen würde. Es ist daher sehr ermutigend, dass keine Berichte über arzneimittelbedingte Nebenwirkungen, eingegangen sind, und wir können nun die optimalen Dosierungsfenster für Afamelanotid mit einem Maß an Komfort aus dieser ersten Studie weiter betrachten.
Die am Tag 8 der Studie analysierten Wirksamkeitsdaten sind gleichermaßen ermutigend. Die National Institutes of Health Stroke Scale (NIHSS) ist ein international anerkanntes und validiertes Instrument zur Bewertung der neurologischen Funktion und Beeinträchtigung nach Schlaganfall und während der gesamten Genesungsphase. Das NIHSS wird von ausgebildeten Klinikern eingesetzt und umfasst 15 Tests zur Beurteilung von Bewusstsein, Sprache, Gesichtsfeldverlust, extraokularer Bewegung, motorischer Kraft, Muskelkontrolle, Sprache und sensorischem Verlust. Das Tool wird auf einer Skala von 0–42 bewertet (höhere Werte bedeuten eine größere Behinderung) und ermöglicht einen konsistenten Ansatz zur Quantifizierung der Schlaganfallschwere sowohl innerhalb eines einzelnen Patienten während der klinischen Behandlung als auch über Kohorten von Patienten in einer Studienumgebung hinweg. Es ist allgemein anerkannt, dass eine Verringerung der NIHSS-Scores um ≥4 Punkte klinisch bedeutsam ist und ein positives Ergebnis für einen Patienten widerspiegelt.
Die am Tag 8 der Studie analysierten Wirksamkeitsdaten sind gleichermaßen ermutigend.
Von den sechs Patienten, die nach dem CUV801-Protokoll behandelt wurden, sahen fünf eine signifikante Verbesserung ihrer Symptome, wie sie am Tag 8 des Protokolls erfasst wurden. Tragischerweise erlitt der sechste Patient am fünften Tag im Krankenhaus einen zweiten, tödlichen Schlaganfall, der von den Neurologen der Alfred Stroke Unit und dem Sicherheitsausschuss von CLINUVEL als in keinem Zusammenhang mit seiner Behandlung mit Afamelanotid stehend eingestuft wurde.
Das CUV801-Protokoll setzt die Patientenüberwachung bis zu 42 Tage nach dem Schlaganfall fort, wobei während dieses Zeitraums Daten erfasst werden. Wenn die Patienten den Überwachungszeitraum abschließen, erwarten wir, mehr über die längerfristigen Auswirkungen der Intervention mit Afamelanotid zu erfahren, sowohl in Bezug auf die Patientensicherheit als auch auf die klinischen Ergebnisse. In der Zwischenzeit wird unser Team weiterhin Daten überprüfen, wie sie in dieser Open-Label-Studie generiert werden, und diese Erkenntnisse auf die nächsten Schritte in unserem Schlaganfallprogramm anwenden, wobei weitere Studien jetzt geplant sind. Bisher war es für unsere Teams lohnend zu erfahren, dass unsere Arbeit dazu beiträgt, die Ergebnisse in vorklinischen Umgebungen in eine potenzielle Behandlung für Patienten umzusetzen, und wir sind gespannt, was uns die vollständigen CUV801-Ergebnisse im Laufe des Jahres lehren werden .
Von den sechs Patienten, die nach dem CUV801-Protokoll behandelt wurden, sahen fünf eine signifikante Verbesserung ihrer Symptome, wie sie am Tag 8 des Protokolls erfasst wurden.
DNA Reparatur
Das DNA-Reparaturprogramm ist eine weitere Übersetzung unserer Melanocortin-Technologie, die sich über drei Protokolle hinweg fortsetzt. Zuletzt behandelte die CUV152-Studie den ersten Patienten mit der Xeroderma-Pigmentosum-Variante (XP-V). Dieses Protokoll ist das erste, das sich auf die Behandlung von XP-V-Patienten konzentriert, wobei sich das bisherige Programm auf XP-C- und krankheitsfreie Probanden in CUV156 bzw. CUV151 konzentriert hat.
XP ist eine seltene lebensbedrohliche Erbkrankheit, die durch Defekte im körpereigenen System zur Reparatur von UV- und lichtinduzierten DNA-Schäden gekennzeichnet ist. Der Defekt von XP-V-Patienten unterscheidet sich von anderen XP-Patienten dadurch, dass nicht der Nukleotid-Exzisions-Reparaturprozess (NER) betroffen ist. Vielmehr können die Zellen von XP-V-Patienten UV-geschädigte oder oxidierte DNA aufgrund eines Defekts im Enzym DNA-Polymerase nicht replizieren. In Abwesenheit dieses Enzyms können andere Polymerasen (die die Läsionen nicht erkennen) die DNA replizieren. Diese Replikationen können dann Fehler verursachen und die Mutagenese verbessern. Darüber hinaus zeigen XPV-Zellen eine erhöhte Empfindlichkeit gegenüber UVA-Licht, welches zu oxidativem Stress führt und die allgemeine Gesundheit und Funktion der Zelle beeinträchtigt.
Das Hauptziel der CUV152-Studie ist das Verständnis der Auswirkungen einer Therapie mit Afamelanotid auf spezifische Marker für DNA-Schäden und -Reparatur. Basierend auf aktuellen Gesprächen mit den die Studie durchführenden Expertenzentren erwarten wir im Jahr 2022 vorläufige Ergebnisse.
Die laufende CUV156-Studie rekrutiert und behandelt weiterhin XP-C-Patienten, deren Ergebnisse später in diesem Jahr erwartet werden. In einem parallelen Protokoll untersucht die CUV151-Studie die Auswirkungen der Behandlung mit Afamelanotid auf DNA-Schäden und -Reparatur in einer nicht betroffenen Population, um festzustellen, ob Unterschiede in der Intervention identifiziert und das Wissen in unsere Programme zurückgeführt werden können.
Das DNA-Reparaturprogramm ist eine weitere Übersetzung unserer Melanocortin-Technologie, die sich über drei Protokolle hinweg fortsetzt.
Der Qualitätssicherungsansatz und -rahmen von CLINUVEL
(Dr Azza Hamila, Leiterin Qualität und Arzneimittelsicherheit)
Qualitätssicherung (QS) von Arzneimitteln ist ein umfassendes Konzept, das alle Aspekte umfasst, die sich auf die Qualität verschriebener pharmazeutischer Produkte auswirken können. Kurz gesagt, QS-Maßnahmen sollen sicherstellen, dass das verschriebene Medikament kompetent die gewünschte Wirkung erzielt, für Patienten sicher ist und den geltenden Vorschriften entspricht. QA ist auch eine Denkweise innerhalb einer Organisation, die sich auf die kontinuierliche Verbesserung von Systemen und deren konsequente Umsetzung konzentriert.
Das globale pharmazeutische Qualitätssystem (PQS) von CLINUVEL umfasst alle von CLINUVEL lizenzierten und nicht lizenzierten Einheiten sowie das Forschungs-, Entwicklungs- und Innovationszentrum VALLAURIX. Angetrieben von Großbritannien und Irland, wo sich die europäischen Arzneimittelzulassungsstellen befinden, besteht unser PQS aus der Koordination mehrerer Qualitätsdurchgangsprozesse mit dem Ziel, Endprodukte von höchster Qualität herzustellen:
Das globale pharmazeutische Qualitätssystem (PQS) von CLINUVEL umfasst alle von CLINUVEL lizenzierten und nicht lizenzierten Einheiten sowie das Forschungs-, Entwicklungs- und Innovationszentrum VALLAURIX.
Gute Herstellungs- und Vertriebspraxis (GMDP)
Gute Herstellungspraxis (GMP) stellt sicher, dass Produkte konsequent gemäß den Qualitätsstandards hergestellt und kontrolliert werden, die für ihren Verwendungszweck und gemäß den Anforderungen der Marktzulassung (MA) oder Produktspezifikation erforderlich sind. Dies gilt für die gesamte Lieferkette, von der Beschaffung von Aminosäurepeptiden für einen pharmazeutischen Wirkstoff (API) bis hin zur Herstellung, Verpackung, Qualitätskontrollprüfung und Chargenfreigabe eines Produkts zur Verwendung in einem bestimmten Markt. Unternehmen können in ihrem Ansatz auch selektiv sein und ihre spezifischen Geschäftsanforderungen widerspiegeln. In ähnlicher Weise erfordert die Gute Vertriebspraxis (GDP), dass Arzneimittel aus der lizenzierten Lieferkette bezogen und konsequent unter geeigneten Bedingungen gelagert, transportiert und gehandhabt werden, wie von der Zulassung oder der Produktspezifikation gefordert. Rückverfolgbarkeit und Authentizität der Produkte sind hier entscheidend.
Die europäische Niederlassung von CLINUVEL mit Sitz in Dublin ist der rechtmäßige Inhaber der Marktzulassung von SCENESSE®, aber auch Inhaber einer Herstellungs- und Einfuhrgenehmigung (MIA), die von den zuständigen irischen Behörden, der HPRA, überwacht wird. Die HPRA inspiziert im Auftrag der Europäischen Arzneimittelagentur regelmäßig den Standort, um die Einhaltung der GMP und des GDP sicherzustellen. Der Import der Implantate in die Europäische Union (EU) und der weltweite Vertrieb erfolgt über die europäische Tochtergesellschaft.
Die britische Tochtergesellschaft, CLINUVEL (UK) LTD, besitzt ebenfalls eine MIA sowie eine Großhandels- und Händlergenehmigung (WDA), die für den Import und Vertrieb von SCENESSE® in das Vereinigte Königreich verwendet wird. Die MHRA, die britische Aufsichtsbehörde, überprüft regelmäßig unseren britischen Standort auf GMP- und GDP-Konformität, sodass wir SCENESSE® nach dem Brexit im Vereinigten Königreich vertreiben können.
Lieferantenqualifizierungssystem
Aufgrund der Globalisierung pharmazeutischer Lieferketten sind die Erwartungen von Herstellern und Sponsoren an die Kontrolle der von ihren Lieferanten bereitgestellten Aktivitäten und Materialien gestiegen. Es liegt in der Verantwortung von CLINUVEL, sicherzustellen, dass seine globalen Lieferanten Dienstleistungen und Materialien bereitstellen, die während des gesamten Lebenszyklus jedes Produkts, von der Produktentwicklung bis zum kommerziellen Vertrieb, für den Zweck geeignet sind. Die Qualitätssicherung von CLINUVEL hat ein Qualifizierungs- und Managementprogramm für Lieferanten implementiert, das auf vier Hauptschritten aufbaut: Entwicklung von Benutzeranforderungen, Sorgfaltspflicht und Auswahl von Lieferanten, Qualitätsbewertung und laufende Überwachung, z. B. durch Audits. Auf diese Weise können wir neue und bestehende Lieferanten bewerten und unsere Lieferkette nach Bedarf anpassen.
Es liegt in der Verantwortung von CLINUVEL, sicherzustellen, dass seine globalen Lieferanten Dienstleistungen und Materialien bereitstellen,
die während des gesamten Lebenszyklus jedes Produkts, von der Produktentwicklung bis zum kommerziellen Vertrieb, für den Zweck geeignet sind.
Qualitätsrisikomanagement
Ein solides Qualitätsrisikomanagementprogramm ist unerlässlich, um die Qualität von Arzneimitteln sicherzustellen, indem es die Identifizierung und Kontrolle potenzieller Qualitätsprobleme während der Entwicklung und Herstellung vorwegnimmt. Die Qualitätssicherung von CLINUVEL hat in all ihren Prozessen und Verfahren einen fortlaufenden risikobasierten Ansatz implementiert. Dies beinhaltet die Identifizierung, Bewertung, Kontrolle, Kommunikation und Überprüfung der Risiken für jeden der Prozesse. Mit diesem Ansatz handeln wir eher proaktiv als rein reaktiv, um unerwünschte Wirkungen zu verhindern oder zu reduzieren und die Patientensicherheit zu gewährleisten. Risiko wird oft nur im negativen Sinne gedacht, aber ein risikobasierter Ansatz kann auch helfen, Chancen zu erkennen und so eine kontinuierliche Verbesserung zu fördern.
Die Qualitätssicherung von CLINUVEL hat in all ihren Prozessen und Verfahren einen fortlaufenden risikobasierten Ansatz implementiert.
Abweichungen und Korrektur- und Vorbeugungsmaßnahmen
Kleinere und vorübergehende Abweichungen gehören zu einem funktionierenden System. Der proaktive Umgang mit Abweichungen und die Minimierung ihrer Wiederholung ist entscheidend für das Funktionieren eines pharmazeutischen Qualitätsmanagementsystems. Wenn eine Abweichung von einer Vorschrift, einem Prozess, einem Verfahren oder den registrierten Spezifikationen festgestellt wird, wird während der Untersuchung eine angemessene Ursachenanalyse unter Anwendung der Prinzipien des Qualitäts-Risikomanagements (QRM) durchgeführt. Anschließend werden geeignete Korrekturmaßnahmen und/oder vorbeugende Maßnahmen (CAPAs) identifiziert und als Reaktion auf die Ergebnisse der Untersuchung ergriffen. Die Wirksamkeit solcher Maßnahmen wird überwacht und bewertet, immer im Einklang mit den QRM-Prinzipien.
Kontrolliertes Dokumentensystem
Die Dokumentation ist der Schlüssel zur Einhaltung der Qualitätssicherung und gewährleistet die Rückverfolgbarkeit aller Entwicklungs-, Herstellungs-, Test- und Vertriebsaktivitäten. Das globale Dokumentationssystem von CLINUVEL stellt sicher, dass allen Mitarbeitern des Unternehmens effektive Richtlinien, Protokolle, Verfahren, Arbeitsanweisungen, Spezifikationen, Testmethoden, Berichtsdokumente, Schulungsmodule und technische Dokumente zur Verfügung gestellt werden.
Schulung und kontinuierliche Verbesserung
Gut qualifizierte Mitarbeiter sind ein wesentlicher Bestandteil von GMDP als Teil der gesamten QS. Daher müssen die Anforderungen an die Qualifikation, Schulung und Entwicklung aller Mitarbeiter, die an GMDP-relevanten Vorgängen beteiligt sind, erfüllt werden, um sicherzustellen, dass die Mitarbeiter die ihnen zugewiesenen Aufgaben entsprechend ihrer Position angemessen ausführen können.
Die neuen Mitarbeiter von CLINUVEL durchlaufen ein Einarbeitungsprogramm, das an ihre Rolle und die ihnen zugewiesenen Aufgaben und Verantwortlichkeiten angepasst ist. Ein kontinuierliches GMDP-Schulungsprogramm wird von der QA-Abteilung für alle relevanten Mitarbeiter unter Einbeziehung der Geschäftsleitung eingerichtet, um sicherzustellen, dass alle von den GMDP-Standards geforderten Aspekte abgedeckt werden. Manager sind dafür verantwortlich, den erforderlichen Schulungsbedarf ihrer Mitarbeiter fortlaufend und insbesondere während der jährlichen Beurteilungsbewertungen zu ermitteln.
Die Leistung des PQS von CLINUVEL wird regelmäßig unter Einbeziehung der Geschäftsleitung überprüft, um Möglichkeiten zur kontinuierlichen Verbesserung der Produkte, Prozesse und des Systems selbst zu identifizieren. Kontinuierliche Verbesserung ist entscheidend für den Erfolg des Unternehmens, da sie zur konsistenten Lieferung sicherer und effizienter pharmazeutischer Produkte mit den entsprechenden Qualitätsmerkmalen beiträgt. Es schafft auch Möglichkeiten für Innovation, wenn die QA-Teams in der gesamten Gruppe ständig Daten auf der Suche nach Trends reflektieren und analysieren. Wenn sie aus den Daten lernen, entwickeln sie auch neue Ideen, um weitere Verbesserungen und Effizienzsteigerungen zu erzielen.
Kontinuierliche Verbesserung ist entscheidend für den Erfolg des Unternehmens, da sie zur konsistenten Lieferung sicherer und effizienter pharmazeutischer Produkte mit den entsprechenden Qualitätsmerkmalen beiträgt.
Geschäftsangelegenheiten von CLINUVEL
(Frau Antonella Colucci, Vizepräsidentin für kaufmännische Angelegenheiten)
Schwerpunkt Kaufmännische Angelegenheiten
Unsere Abteilung für kaufmännische Angelegenheiten spielt eine aktive Rolle bei der Unterstützung der allgemeinen Geschäftstätigkeit des Unternehmens. Wir haben Kontakte und Beziehungen zu Dienstleistern, Krankenhäusern und Ärzten aufgebaut und gepflegt, die für die Unterstützung der kommerziellen Versorgung von CLINUVEL unerlässlich sind. Diese Arbeit ist Teil eines konsequenten Ansatzes, den ich seit 11 Jahren leite. Dies ist am relevantesten für die Sorgfalt, mit der solide Beziehungen zu allen Parteien und Personen aufgebaut werden, die an der Verteilung von SCENESSE® (Afamelanotid 16 mg) zur Behandlung erwachsener EPP-Patienten beteiligt sind.
Nicht nur die Ärzte, sondern auch das Apothekenpersonal und die Beschaffungs- und Finanzfachleute in jedem europäischen Porphyrie-Expertenzentrum, in dem EPP-Patienten behandelt werden, sind von entscheidender Bedeutung. Unser Team tauscht sich regelmäßig mit den aktiven Zentren aus, um Rückmeldungen über die bereitgestellte Behandlung, die erwartete Anzahl von Patienten und Behandlungsmuster zu erhalten. SCENESSE® ist ein hochwertiges Produkt, das in kleinen Chargen hergestellt wird, und daher muss die Lieferung jedes einzelnen Implantats genau geplant werden, damit die Bedürfnisse der Patienten rechtzeitig erfüllt werden. Wir sind uns bewusst, dass einige EPP-Patienten eine Auszeit von der Arbeit oder dem Familienleben nehmen müssen, um zu ihrem Behandlungszentrum zu reisen, und wir bemühen uns sicherzustellen, dass es bei der Lieferung von SCENESSE® zu keiner Verzögerung kommt. Auch klinische Apotheken spielen eine zentrale Rolle beim Vertrieb von SCENESSE®. Sie sind der erste Ansprechpartner unseres Teams, wenn sie Bestellungen aufgeben und das Produkt unter kontrollierten Bedingungen erhalten. Unser Fokus liegt darin, ein zuverlässiger Partner zu sein, und wir bemühen uns, alle Fragen zu Logistik und Vertrieb noch am selben Tag zu beantworten.
Der wirkliche Unterschied für den reibungslosen Ablauf des SCENESSE®-Vertriebs sind die produktiven und positiven Beziehungen, die sich durch die Treffen unseres Teams mit Ärzten, Apothekern, aber auch Aufsichtsbehörden im Laufe der Jahre entwickelt haben, einschließlich Besuchen in Behandlungszentren und Networking bei wissenschaftlichen Veranstaltungen. Dies bietet die „menschliche Note“, die sich als unschätzbar erwiesen hat, um die reibungslose Verteilung im Laufe der Jahre und in jüngster Zeit im schwierigen Betriebsumfeld von COVID-19 sicherzustellen.
Der wirkliche Unterschied für den reibungslosen Ablauf des SCENESSE® – Vertriebs sind die produktiven und positiven Beziehungen, die sich durch die Treffen unseres Teams mit Ärzten, Apothekern, aber auch Aufsichtsbehörden im Laufe der Jahre entwickelt haben, einschließlich Besuchen in Behandlungszentren und Networking bei wissenschaftlichen Veranstaltungen.
Im Folgenden gehe ich auf die wichtigsten Errungenschaften in kommerziellen Angelegenheiten und aktuelle Initiativen ein, die das zukünftige kommerzielle Wachstum des Unternehmens prägen werden.
Ein Jahrzehnt Schweizer Vertrieb
Die Schweiz war eines der ersten Länder weltweit, das den Zugang zu SCENESSE® zur Prävention von Phototoxizität bei erwachsenen EPP-Patienten erlaubte. Seit Mai 2012 wird SCENESSE® in der Schweiz gemäss spezifischem Reglement vertrieben und von den Schweizer Krankenkassen vergütet.
Das Hauptaugenmerk von CLINUVEL lag darauf, das medizinische Team bei seinen Bemühungen zur Behandlung von EPP-Patienten zu unterstützen. Unsere Erfahrung in der Schweiz hat gezeigt, dass ein kooperativer Ansatz bei der Zusammenarbeit mit den Kostenträgern den Zugang der Patienten zur Behandlung am besten erleichtert. Wir wussten, dass EPP eine kaum verstandene Erkrankung ist (und bleibt), und wir waren immer bereit, mit Schweizer Versicherern darüber zu diskutieren, um das Bewusstsein für die Krankheit zu schärfen und ihnen zu helfen, den wahren klinischen Wert von SCENESSE® für EPP-Patienten zu verstehen. Dieser Ansatz hat sich bewährt und allen behandlungsbedürftigen Schweizer EPP-Patienten wird der Zugang gewährt.
Aus klinischer Sicht veröffentlichten schweizerische und italienische Ärzte 2015 die erste Beobachtungsstudie zu SCENESSE® in EPP, und vor kurzem hat Dr. Anna Minder eine weitere Beobachtungsstudie veröffentlicht, die die schützende Wirkung von Afamelanotid auf die Leber belegt (wie in News Communiqué I berichtet – 2022).
Unsere Erfahrung in der Schweiz hat gezeigt, dass ein kooperativer Ansatz bei der Zusammenarbeit mit den Kostenträgern den Zugang der Patienten zur Behandlung am besten erleichtert.
Kontrolliertes Vertriebsnetz
Nur erwachsene Patienten mit einer bestätigten EPP-Diagnose können mit SCENESSE® behandelt werden. CLINUVEL verpflichtet sich, SCENESSE® in Übereinstimmung mit den Bestimmungen des Risikominimierungsplans (RMP) zu vertreiben, der am 22. Dezember 2014 nach der zentralisierten Marktzulassung in der Europäischen Union (EU) genehmigt wurde. Um das Risiko einer Off-Label-Anwendung zu minimieren, haben wir a streng kontrolliertes Vertriebsprogramm, um sicherzustellen, dass die SCENESSE®-Behandlung die richtigen Patienten durch europäische EPP-Expertenzentren erreicht.
Seit Juni 2016, als SCENESSE® erstmals in der EU eingeführt wurde, wird der europaweite Vertrieb vollständig vom CLINUVEL-Team verwaltet. Unsere Standardarbeitsanweisungen beinhalten keinen Vertrieb durch lokale pharmazeutische Großhändler, was unserem kontrollierten Zugangsprogramm eine Unsicherheitsvariable hinzufügen würde. Bestellungen werden von Expert Centers an unser Team gesendet und intern bearbeitet. Unsere externen Vertriebspartner liefern das Produkt gemäß den detaillierten Anweisungen unseres Teams. SCENESSE® wird ausschließlich an Krankenhausapotheken geliefert und in keinem Fall an Präsenzapotheken abgegeben. Nach der Lieferung bestätigt der Apotheker, der ebenfalls zuvor vom CLINUVEL-Team geschult wurde, die Lieferung, indem er eine unterschriebene und datierte Empfangsbestätigung und eine Kopie der Temperaturanzeige zurücksendet. Da SCENESSE® immer gekühlt werden muss, wird die Temperaturanzeige sofort von unserem Qualitätssicherungsteam kontrolliert. Im Falle von Temperaturabweichungen außerhalb des zulässigen Bereichs werden sich unsere Mitarbeiter an den Standort wenden und Sie über die Eignung und Sicherheit des Produkts für die Verwendung am Patienten beraten.
CLINUVEL verpflichtet sich, SCENESSE® in Übereinstimmung mit den Bestimmungen des Risikominimierungsplans (RMP) zu vertreiben, der am 22. Dezember 2014 nach der zentralisierten Marktzulassung in der Europäischen Union (EU) genehmigt wurde.
Schlüsselinitiativen
Wir haben ein laufendes Programm zur Verteilung von SCENESSE® an EPP-Patienten in neuen Gerichtsbarkeiten. Dazu gehören eine Reihe von Ländern in Europa, in denen wir versuchen, Vereinbarungen über die Erstattung der Behandlungskosten mit wichtigen Kostenträgern voranzutreiben. Dieses Ziel erstreckt sich auch auf Australien. In anderen Regionen der Welt arbeiten wir daran, die für den Vertrieb von SCENESSE® erforderlichen behördlichen Genehmigungen zu erarbeiten, und erwähnen insbesondere China und Japan, wo es behandlungsbedürftige EPP-Populationen gibt. In China schreitet unsere Beziehung zu Winhealth Pharma voran, wobei der Schwerpunkt auf einem benannten Patientenprogramm liegt, um ein chinesisches Patientendossier zu erstellen. Hier versuchen wir, lokale Daten mit den weltweit erfassten Sicherheits- und klinischen Vorteilen zu kombinieren, um uns an die chinesischen Behörden zu wenden, um eine Zulassung zum Vertrieb von SCENESSE® zu prüfen.
We have an ongoing program to distribute SCENESSE® to EPP patients in new jurisdictions.
Kommunikation und Investor Relations
(Herr Malcolm Bull, Head of Australian Operations & Investor Relations)
Aktuelle Ankündigungen
Das Unternehmen hat seit Anfang des Jahres mit einer Reihe von wichtigen Ankündigungen und Webinaren/Webcasts einen aktiven Informationsfluss über den Geschäftsverlauf aufrechterhalten, wie im Folgenden beschrieben:
| Datums | Ankündigung |
|---|---|
| 10 Januar | Präsentation vor H.C. Wainwright Bioconnect-Konferenz |
| 17 Januar | Aufnahme der CUV801-Schlaganfallstudie abgeschlossen |
| 24 Januar | SCENESSE® in Deutschland fortgesetzt |
| 27 Januar | Nachrichtenkommuniqué I – 2022 |
| 31 Januar | Quartalsaktivitäten zum / Anhang 4C Cashflow-Bericht |
| 14 Februar | Erweiterung DNA-Reparatur mit zweiter Studie |
| 16 Februar | Advice of Operations Update Webcast (gehalten am 23. Februar) |
| 23 Februar | Anhang 4D Halbjahresbericht |
| 28 Februar | CEO-Brief vom (und Webcast) |
| 15 März | Afamelanotid bei Schlaganfall (AIS) – Positive vorläufige Ergebnisse |
| 17 März | ACTH Manufacturing Update |
| 30 März | Erster XP-V-Patient in dritter CUV-DNA-Reparaturstudie behandelt |
| 31 März | Nachrichtenkommuniqué II – 2022 |
Alle Ankündigungen von CLINUVEL sind auf der CLINUVEL-Website und in CLINUVELNews verfügbar. Genauer gesagt sind Ankündigungen an die Australian Securities Exchange auf den Investorenseiten der CLINUVEL-Website verfügbar.
Zusammenfassung der Finanzergebnisse
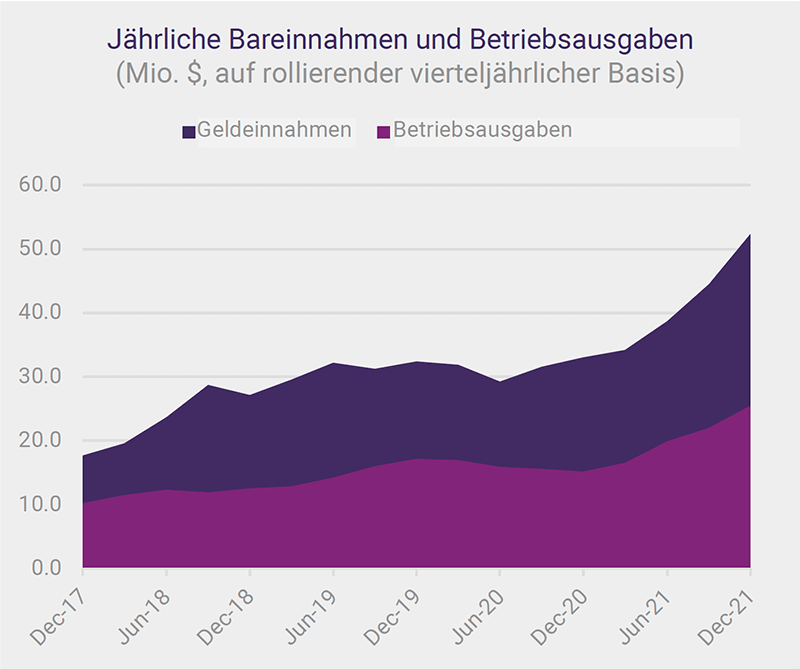
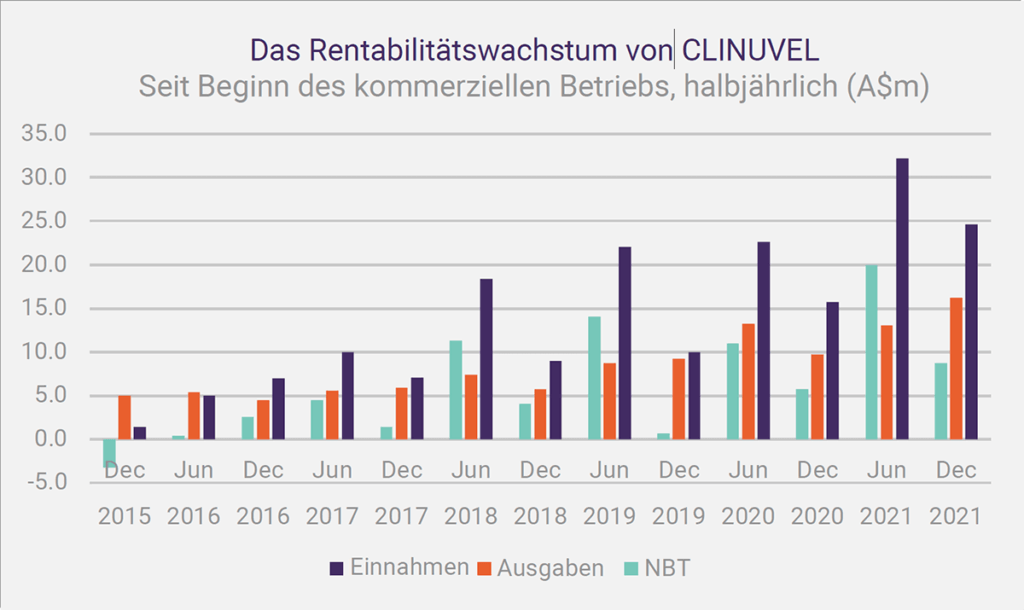
Seit dem News Communiqué I – 2022 haben ¬wir das Cashflow-Ergebnis des Dezemberquartals 2021 und die Finanzergebnisse für das am 31. Dezember 2021 endende Halbjahr bekannt gegeben. Rekordeinnahmen für ein Dezemberquartal und Rekordeinnahmen und Betriebsgewinn für ein Dezemberhalbjahr weisen auf die Gesundheit hin finanzielle Leistungsfähigkeit des Unternehmens. Der Vertrieb von SCENESSE® in Europa, den USA und Israel wächst weiter und generiert einen positiven Cashflow, um die Ausgaben zu decken, die für die Ausweitung des Geschäfts und die Erhöhung der Barreserven auf knapp 99 Millionen AUD zum 31. Dezember 2021 erforderlich sind. Der Vorteil dieser Position , insbesondere im aktuellen Umfeld, darf nicht unterschätzt werden.
Rekordeinnahmen für ein Dezemberquartal und Rekordeinnahmen und Betriebsgewinn für ein Dezemberhalbjahr weisen auf die Gesundheit hin finanzielle Leistungsfähigkeit des Unternehmens.
Darren Keamy, CFO, und Lachlan Hay, Director of Global Operations, beantworteten in Operations Update I – 2022 die wichtigsten Fragen der Interessengruppen zu den Halbjahresergebnissen. Herr Keamy und ich hielten auch Präsentationen vor institutionellen Anlegern direkt und über von unabhängigen Analysten veranstaltete Meetings. Darüber hinaus beantworteten wir in Einzelgesprächen und E-Mails die Fragen anderer Aktionäre zu verschiedenen geschäftsrelevanten Themen.
Jeder der unabhängigen Research-Analysten veröffentlichte nach den Halbjahresergebnissen aktualisierte Berichte. Wir schätzen ihre kontinuierliche Arbeit und Forschung, insbesondere die zunehmende Anerkennung des inkrementellen Werts, der durch den Fortschritt des erweiterten klinischen Programms geschaffen wird.
Brief und Webcast des CEO
Der CEO gab Ende Februar / Anfang März in einem Brief und Webcast einen Überblick über die Marktposition, das Finanzmanagement und das Wachstum von CLINUVEL. Dr. Wolgen kommentierte, dass der Rückgang des Aktienkurses seit Ende September 2021 in direktem Gegensatz zur positiven anhaltenden Entwicklung des Unternehmens mit der Erzielung von Rekordeinnahmen, Umsätzen und Betriebsgewinnen in den letzten Berichtszeiträumen stehe. Er stellte auch den deutlichen Anstieg der Ausgaben (um 67 %) im Halbjahr zum 31. Dezember 2021 in den Kontext der in der Hauptversammlung im November 2021 angekündigten geplanten Gesamtausgaben von 175 A$ über fünf Geschäftsjahre (2021 bis 2025). Dies wurde von Interessenvertretern gut aufgenommen, die auch einstimmig ihre Unterstützung für die Position des Unternehmens zur unentschuldbaren Invasion der Ukraine durch Russland zum Ausdruck brachten.
Wir werden die Interessengruppen weiterhin über den Fortschritt der klinischen Programme informieren, sobald neue Daten verfügbar sind. Die nächsten Finanzdaten des Unternehmens werden die Bareinnahmen für das Märzquartal 2022 sein, die bis Ende April 2022 veröffentlicht werden.
…, dass der Rückgang des Aktienkurses seit Ende September 2021 in direktem Gegensatz zur positiven anhaltenden Entwicklung des Unternehmens mit der Erzielung von Rekordeinnahmen, Umsätzen und Betriebsgewinnen in den letzten Berichtszeiträumen stehe.
Das Warum?
(Dr Philippe Wolgen, Geschäftsführer)
Ein prominenter US-Aktionär, der CLINUVEL mit seinen anderen Life-Science-Investitionen verglich, bat mich, unsere Herangehensweise an das Pharmageschäft und unsere eher differenzierende Strategie offen zu erläutern. Dies war eine gute Frage, da angenommen wird, dass viele US-Investoren die Erfolge von CLINUVEL kaum wahrzunehmen scheinen. Gerne nutze ich die Gelegenheit, um unsere ausgewogenen Ansichten über das Geschäft und die Zukunft zu teilen.
Obwohl allgemeine Aussagen nicht unbedingt immer zutreffen, gibt es dennoch drei sich wiederholende Themen, die unsere Führung des Unternehmens beeinflussen:
- Erstens unterscheiden wir zwischen wesentlichen und nicht wesentlichen Dienstleistungen, Gütern und Produkten während wirtschaftlicher Schrumpfungen. Diese Gabelung diente als grober Leitfaden, um diejenigen Unternehmen zu identifizieren, die in der Lage sind, zu überleben und kontinuierliche Marktaufmerksamkeit zu erregen, und diejenigen, die regelmäßig Probleme haben.
- Zweitens versuchten wir, aus vergangenen Wirtschaftskrisen (insbesondere der globalen Finanzkrise) zu lernen, und nahmen damit eher eine präventive als eine reaktionäre Haltung ein.
- Drittens überwachen wir sorgfältig die Bewertungen innerhalb unseres Sektors und schreiben realistische Szenarien sowohl für hohe als auch für niedrige Märkte zu, mit besonderem Bezug auf den größten Pharmamarkt, die USA. Dabei betrachten wir die Bilanzstärke als einen der Parameter, der Anleger langfristig von Unsicherheit befreit und die Bewertungen positiv beeinflusst.
In Zeiten, in denen die Marktvolatilität vorherrscht, glauben wir, dass es noch größeren Bedarf an einer globalen Sicht auf die Volkswirtschaften gibt, während sie es ermöglicht, diese Beobachtungen auf CLINUVEL zurückzubringen. Beginnen wir also aus der Vogelperspektive.
Wenn physische Einschränkungen weltweit aufgrund eines einzigen Virusausbruchs vor drei Jahren unwahrscheinlich erschienen wären, haben wir gesehen, wie Fluggesellschaften und viele andere Unternehmen, die sich auf diskretionäre Dienstleistungen konzentrierten, an den Rand des Bankrotts gebracht wurden. In einigen europäischen Korridoren starb der Einzelhandel auf Hauptstraßen aus, und die Unfähigkeit der Menschen, physisch zu interagieren, führte zu einer Lähmung von Freizeit- und Gastgewerbebetrieben. Unmittelbar in der Folge verstärkte die Ukraine-Krise die Angst vor wirtschaftlichen Verwerfungen und heizte die Inflation an.
Nun, zum einen hat die Pandemie die Macht der Nachfrage von Patienten und Ärzten gezeigt. Im Fall von CLINUVEL waren Porphyrie-Patienten bereit zu reisen, das Risiko einzugehen, Sperren zu durchbrechen und sich unter isolierten Bedingungen behandeln zu lassen. Diese ungewöhnlich starke Bereitschaft, sich sowohl in den USA als auch in der EU behandeln zu lassen, bestätigte unsere Teams darin, dass Afamelanotid von den Endverbrauchern selbst mehr oder weniger als „wesentliche Behandlung“ wahrgenommen wurde, die ihnen selbst unter den widrigsten Bedingungen ein Leben in Freiheit ermöglicht . Diese klinische Beobachtung ist nicht nur wertvoll – auch ohne das Auftreten dieses Phänomens tatsächlich geplant zu haben – sondern beeinflusst unsere Entscheidungen und unsere zukünftige Ausrichtung stark.
Zweitens glauben wir fest an die zyklische Natur von Unternehmen, und in einem dynamischen Preisumfeld für pharmazeutische Produkte besteht immer das Risiko, dass ein stabiler wirtschaftlicher Zustand gestört wird, was sich auf innovative pharmazeutische Produkte auswirkt. Krankenversicherer suchen ständig nach neuen Wegen, um Arzneimittelpreise neu zu verhandeln, und unserer Ansicht nach ist die Antizipation möglicher zukünftiger Änderungen für jedes Pharmaunternehmen obligatorisch. Um die Geschäftsrezession zu beweisen, halten wir uns daher an eine Kapitaladäquanzregel, die CLINUVEL auf unvorhergesehene Schwankungen vorbereitet. Auch hier hat unsere Finanzstrategie während vergangener Marktkorrekturen eine weitere Eigen- oder Fremdfinanzierung vermieden. Ich würde zwar keinen Wechsel in diesem Management befürworten, aber neue Zeiten, neue Bedingungen und Möglichkeiten können unsere Ansichten ändern. Im Allgemeinen war das bisherige Feedback zu einer präventiven Strategie zur haushaltspolitischen Umsicht sehr positiv.
…, Um die Geschäftsrezession zu beweisen, halten wir uns daher an eine Kapitaladäquanzregel, die CLINUVEL auf unvorhergesehene Schwankungen vorbereitet.
Drittens, bei der Überwachung und dem Vergleich von CLINUVEL mit anderen Melanocortin-Unternehmen und Spezialpharmazeutika, aber auch mit unzähligen anderen Innovatoren in unserer Branche, ist es wichtig, dass Bewertungen für uns wichtig sind, um den Überblick zu behalten. Neben vielen Variablen berücksichtigen wir die Verwässerungsrate, die adressierbaren Märkte und die Bilanz. Das Kurs-Buchwert-Verhältnis und das Kurs-Gewinn-Verhältnis geben einige Hinweise darauf, wie CLINUVEL sowohl in guten als auch in schlechten Märkten im Vergleich zu anderen agiert.
Noch ein paar Worte zum Ansatz von CLINUVEL
Ich habe den Vorteil, in zwei Funktionen zu sprechen, als größerer Anteilseigner von CLINUVEL, der genau Ihre Interessen teilt, und als täglicher Manager. Betrachten wir aus diesen beiden Perspektiven die aktuelle Unternehmensgeschichte, die sich im Laufe der Zeit entwickelt hat.
Es gibt Überschneidungen in meinen zweifachen Standpunkten. Als Anteilseigner möchte ich – so weit ich von außen dazu in der Lage bin – die Risiken des Unternehmens und seines Managements nach einem methodischen Programm zur Beseitigung dieser Risiken verstehen. Wie passt man sich kontinuierlich an neue unvorhergesehene Risiken an? Als Investor möchte ich Wachstum, frühe Gewinne und neue Projekte sehen, cum quoque-Investitionen.
Als Mitaktionär wünsche ich mir eine Life-Science-Gruppe, die in der Lage ist, lange Zyklen zu bewältigen, innovativ zu sein und bei jeder Gelegenheit ihr Bestes zu geben, um diese Äonen ohne Verwässerung des Eigenkapitals zu bewältigen. Die Eigenkapitalkosten zeigen sich beispielhaft in vielen Unternehmen, die schließlich zum Erliegen gekommen sind oder tatsächlich keinen kommerziellen Wert aus ihren Produkteinführungen realisieren.
Ich habe den Vorteil, in zwei Funktionen zu sprechen, als größerer Anteilseigner von CLINUVEL, der genau Ihre Interessen teilt, und als täglicher Manager.
Als Manager stehen Risiken im Vordergrund, und diese Einstellung hat zur aktuellen Position von CLINUVEL geführt.
Da die Bewertungen gefallen sind und Life-Science-Unternehmen derzeit unter Druck stehen, hätte das Unternehmen auf herkömmliche Weise sechs Monate Barmittel mit sich führen und die meiste Zeit damit verbringen müssen, die Geschichte zu präsentieren, um Mittel zu beschaffen. Als Aktionär frage ich mich, wie das Unternehmen heute ausgesehen hätte und wie es in der Zukunft aussehen könnte, inmitten der vorherrschenden Ungewissheit? Als Manager frage ich mich, wie viele Manager unter diesen Umständen im Unternehmen geblieben wären und wie viel Talent und Wert das Unternehmen verlassen hätte?
Abschließend sehe ich es als meine Hauptaufgabe an, jungen Generationen neuer Mitarbeiter Hoffnung und Ehrgeiz zu geben, um das Unternehmen voranzubringen. Ein Ratschlag, den ich unseren Managern mit auf den Weg gebe, ist, immer eine letzte Option für sich zu behalten, das beste Projekt nah bei sich zu behalten und es auszuspielen, wenn die Katastrophe ausbricht.
Nachdem ich Ihnen zwei Standpunkte mitgeteilt habe, verlasse ich Sie mit der Vorstellung, dass sich das Unternehmen nicht in einer besseren finanziellen Position befand, während der plötzliche Anstieg des Aktienkurses von CLINUVEL im September 2021 und der Rückgang in den Folgemonaten in keinem Zusammenhang mit unserem kommerziellen Fortschritt stehen und Entwicklung.
… dass sich das Unternehmen nicht in einer besseren finanziellen Position befand, während der plötzliche Anstieg des Aktienkurses von CLINUVEL im September 2021 und der Rückgang in den Folgemonaten in keinem Zusammenhang mit unserem kommerziellen Fortschritt stehen und Entwicklung.
Zusammenfassung und Schlussfolgerung
Viele Wege führen nach Rom, sagt man. Wir haben eine bewusste und fokussierte Strategie gewählt, die über viele Jahre umgesetzt wurde und zu der starken Position von CLINUVEL geführt hat.
CLINUVEL entwickelte sich von einem Konzept mit einem Medikament zu seiner Verwendung für den systemischen Lichtschutz, wechselte zur Unterstützung der Reparatur von DNA-geschädigter Haut und entwickelt sich weiter zu einem B2C-Markt für Bevölkerungsgruppen mit dem höchsten Risiko von Sonnenschäden und Hautkrebs. Wir haben unser Wissen und unsere Technologie auf Erkrankungen des Zentralnervensystems übertragen und neue Moleküle hinzugefügt, die zur gleichen Melanocortin-Familie gehören. Dabei baute das Unternehmen eine Infrastruktur auf, die die meisten Fähigkeiten intern einbrachte, und baute eine starke finanzielle Position auf.
Wer in Biowissenschaften investiert, weiß, dass man sich darauf verlassen kann, dass sich alle Ereignisse zugunsten der Entwicklung entwickeln. Ein Biotech-Unternehmen zu betreiben bedeutet, den Rand des Scheiterns zu suchen und gleichzeitig sicherzustellen, dass man viele der internen Risiken kontrollieren kann. Es gibt keine absolute Garantie, dass sich CLINUVEL weiterhin gut entwickeln wird, aber die Punkte der letzten Jahrzehnte können verbunden werden, um eine Trendlinie zu zeichnen.
Wir wünschen allen Beteiligten weiterhin Sicherheit und Fortschritte bei ihren Zielen.
Malcolm Bull, Leiter des australischen Betriebs und der Investor Relations
Es gibt keine absolute Garantie, dass sich CLINUVEL weiterhin gut entwickeln wird, aber die Punkte der letzten Jahrzehnte können verbunden werden, um eine Trendlinie zu zeichnen.
Autorisiert für ASX-Freigabe durch den Verwaltungsrat von CLINUVEL PHARMACEUTICALS LTD.
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, die die aktuellen Ansichten und Erwartungen des Managements von CLINUVEL widerspiegeln. Aussagen können eine Reihe bekannter und unbekannter Risiken beinhalten, die dazu führen können, dass unsere zukünftigen Ergebnisse, Leistungen oder Errungenschaften erheblich von denen abweichen, die in solchen zukunftsgerichteten Aussagen ausgedrückt oder impliziert werden. Wichtige Faktoren, die solche Unterschiede verursachen oder dazu beitragen könnten, umfassen Risiken in Bezug auf: unsere Fähigkeit, pharmazeutische Produkte zu entwickeln und zu vermarkten; die COVID-19-Pandemie und/oder andere weltweite, regionale oder nationale Ereignisse, die die Lieferkette über einen längeren Zeitraum betreffen, einschließlich unserer Fähigkeit, biopharmazeutische Produkte zu entwickeln, herzustellen, zu vermarkten und zu verkaufen; Konkurrenz für unsere Produkte, insbesondere SCENESSE® (afamelanotid 16mg), PRÉNUMBRA® oder NEURACTHEL®; unsere Fähigkeit, durch unsere innovativen F&E-Bemühungen die erwarteten Sicherheits- und Wirksamkeitsergebnisse zeitnah zu erzielen; die Wirksamkeit unserer Patente und anderer Schutzmaßnahmen für innovative Produkte, insbesondere angesichts nationaler und regionaler Unterschiede im Patentrecht; unsere potenzielle Gefährdung durch Produkthaftungsansprüche, soweit nicht durch eine Versicherung gedeckt; verstärkte staatliche Kontrolle unserer Vereinbarungen mit Dritten und Lieferanten in Australien, den USA, Europa, Israel, China und Japan; unsere Exposition gegenüber Währungsschwankungen und -beschränkungen sowie Kreditrisiken; die Auswirkungen von Reformen der Gesundheitsregulierung und der Arzneimittelpreise und -erstattung; dass das Unternehmen unerwartete Verzögerungen bei der ausgelagerten Herstellung von SCENESSE®, PRÉNUMBRA® oder NEURACTHEL® erleiden kann, was dazu führen kann, dass es seine kommerziellen Märkte und/oder klinischen Studienprogramme nicht beliefern kann; jegliche Nichteinhaltung von Melde- und Zahlungsverpflichtungen gegenüber staatlichen Zahlungssystemen (d. h. Medicare); Unsicherheiten im Zusammenhang mit den gesetzlichen und regulatorischen Pfaden für die Registrierung und Zulassung von Biotechnologie und verbraucherbasierten Produkten; Entscheidungen von Aufsichtsbehörden über die Zulassung unserer Produkte sowie deren Entscheidungen in Bezug auf Etikettenaussagen; unsere Fähigkeit, Schlüsselpersonal und Führungstalente zu halten oder anzuziehen; die Auswirkungen umfassenderer Veränderungen innerhalb der pharmazeutischen Industrie und verwandter Industrien; potenzielle Änderungen der Steuerverbindlichkeiten oder der Gesetzgebung; Umweltrisiken; und andere Faktoren, die in unserem Geschäftsbericht 2021 erörtert wurden.
Zukunftsgerichtete Aussagen beziehen sich nur auf das Datum, an dem sie gemacht werden, und das Unternehmen übernimmt keine Verpflichtung, abgesehen von den nach geltendem Recht oder den einschlägigen Notierungsvorschriften der Australian Securities Exchange vorgeschriebenen, zukunftsgerichteten Aussagen zu aktualisieren oder zu überarbeiten, sei es aufgrund neuer Informationen, zukünftiger Ereignisse oder aus anderen Gründen. Weitere Informationen zu vorläufigen und unsicheren Prognosen und Schätzungen sind auf Anfrage erhältlich, wobei darauf hingewiesen wird, dass die Wertentwicklung der Vergangenheit kein Indikator für die zukünftige Wertentwicklung ist.
Kontact
Level 11, 535 Bourke St
Melbourne, 3000 Vic,
Australia
+61 3 9660 4900
+61 3 9660 4909